脳の可塑性(かそせい)とは ー 脳局在のコペルニクス的転回
2021年6月15日
横浜なみきリハビリテーション病院 院長 脳神経内科
阿部 仁紀
前回のコラムで説明いたしましたが、脳卒中は脳血管障害の結果であり、脳血管障害が原因です。そして、脳卒中の原因である脳の血管を治療するのが、脳神経内科医や脳神経外科医(の血管内治療医)であり、その結果である脳の神経障害を主に治療するのがリハビリテーション医学でありそのスタッフです。もちろんこれは、脳卒中に限っての話であり、基本的には脳の障害を治療するのは脳神経内科や脳神経外科です。
脳の障害が治療可能である、その基本概念が「脳の可塑性(かそせい)brain plasticity」です。 2021年1月1日の「ドクターコラム」でも記載いたしましたが、リハビリテーションのキーワードの一つに「可塑性(かそせい)plasticity」があります。可塑性とは、変化して、その変化が持続することです。今回はその可塑性について詳しく説明いたします。
まずは、基本から。ドイツの解剖学者コルビニアン・ブロードマンKorbinian Brodmann(
文献1,図1)は、細胞染色のNissl法を使用し、大脳皮質で観察されたニューロンの顕微鏡的細胞構造の違いに基づいてブロードマンの脳地図(
文献2,p164)を定義し、番号を付けた。ブロードマンは、異なる構造を持つ領域が異なる機能を実行することを仮定した。そして実際にペンフィールドらがその機能を観察し意味付けを行った。
カナダの神経外科医であるペンフィールドWilder Penfieldは、1930~1950年代までMcGill大学で働き、皮質表面の電気刺激により、体の特定の部位の体性感覚を生じさせることによって神経外科の患者の皮質をマッピングした
(文献2,3)(これらの脳手術は頭皮への局所麻酔のみを用い、覚醒した患者で可能である。なぜなら、脳自体は体性感覚受容器を持たないからである)。体表面の感覚が脳の構造にマッピングされたものは
体部位局在somatotopyとよばれている(
文献4, 図2)。別な言い方をすると、Penfieldはさまざまな脳領域の刺激に基づく膨大な知見をもとに、ヒト大脳の一次運動野と一次体性感覚野のホムンクルス(homunculus, 小人間像)として知られる体性地図の存在を明らかにするなど、ヒト脳の大脳皮質に機能局在があることを明らかにしました
(文献5)。
ブロードマン3b野は一次体性感覚野(primary sensory cortex; S1)。ブロードマン1および2野は3b野から豊富な入力を受ける。深部受容器からの情報は3a野に、皮膚感覚からの情報は3b野に主に入る
(文献6)。3bから1野への投射は主に質感(手触りtexture)の感覚であり、一方2野は大きさや形に関する情報である(
文献2, 図12.16)。
図1


図2(文献4)




皮質部位局在地図の可塑性(文献2、p312-314、図12.22)
例えば、指からの入力が取り除かれた時、皮質の体性感覚地図には何が起こるだろうか。単純に、皮質の“指の領域”が利用されなくなるのだろうか。萎縮が起こるのだろうか。あるいはそれ以外の領域からの入力に取って代わられるだろうか。この疑問に対する答えは、末梢神経障害後の機能回復に関して重要な示唆を与える。1980年代にカリフォルニア大学サンフランシスコ校の神経学者Michael Merzenichと共同研究者は、このことに関する一連の実験を行った。
鍵となる実験を図12.22に要約する。まず初めに、生体のヨザルで手の刺激に対する感受性を持つS1野の地図が、微小電極で注意深く検索された。次いで、手の1本の指が外科的に切除された。数か月後、S1野が再び検索された。結果はどうだったのだろうか。切除された指に当てられていたもとの皮質領域は、隣接する指の刺激に反応したのである(図12.22c)。皮質の部位局在の基盤をなす神経回路網に、明らかな再配列が起こったのである。
指の切除実験では、地図の再編成の原因は失われた指からの入力の消失であった。では、もし指からの入力活動が増加した場合、何が起こるだろうか。この問に答えるために、サルはエサを報酬として受け取るために、指定された指を利用するように訓練を受けた。数週間の訓練の後、微小電極で地図を検索した結果、刺激されていない指と比較して、刺激された指の部位は、該当する局在部位が拡大していることが明らかとなった(図 12.22d)。これらの実験から、皮質地図は感覚経験の量に応じて動的に変化することが明らかになった。これに続いて行われたその他の皮質領野(視覚野、聴覚野、運動野)の実験でも、このような皮質地図の可塑性が脳で広く行きわたっていることが示されている。

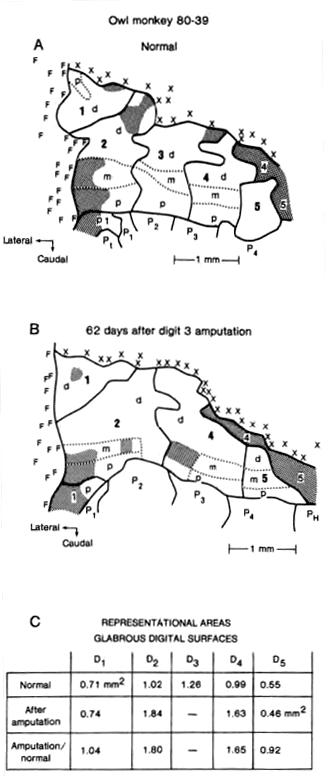
イラストではなく、実際の論文 (文献7)をみてみましょう。この論文が本日のサブタイトル、「脳局在のコペルニクス的転回」の嚆矢となった歴史的論文です。下記の図が原著の図です。Bは右第3指を切断(amputation)し62日後のowl monkeyの左半球の脳皮質を横にしたものです。5指領域が上です。確かに第3指の領域が消失し、第2指の切断後/正常の比が1.80そして第4指の切断後/正常の比が1.65と大きく増加しております。
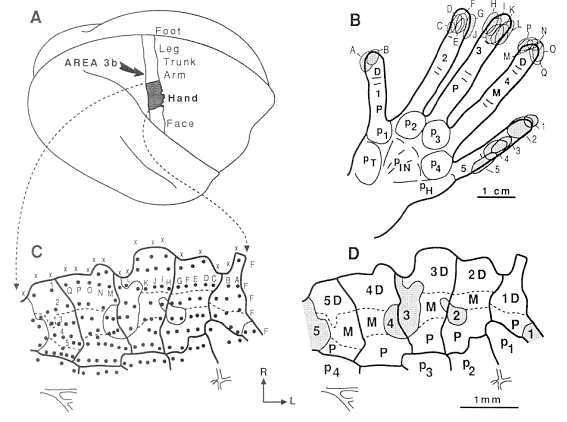
もう一つの論文もお示しします (文献8)。これは正常のadult owl monkeyの右新皮質です。当然手は左手です。Dはdistal(末節), Mはmiddle(中節), P はproximal phalanges(基節骨)です。P1-4はthe palmar padsです。
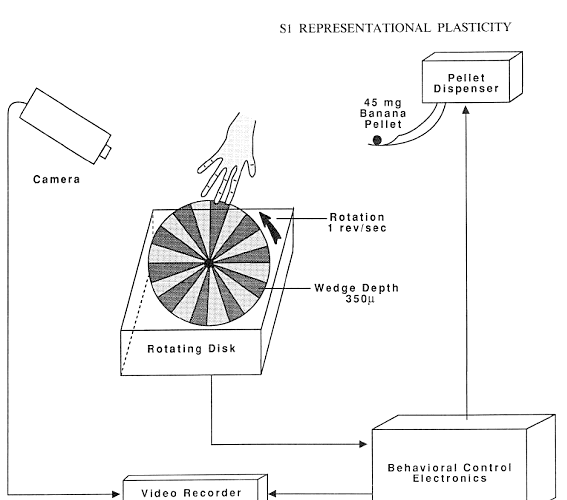
指の訓練装置です。
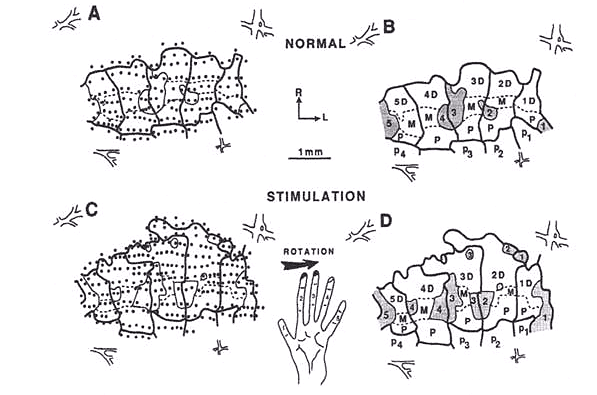
第2,3指を訓練した後の図です。A, Bが正常、C, Dが第2,3指を刺激したものです。全体的に領域が広くなっているとともに、たしかに第2,3指の領域が広く、特にdistal指先の領域(2D, 3D)が広くなっております。
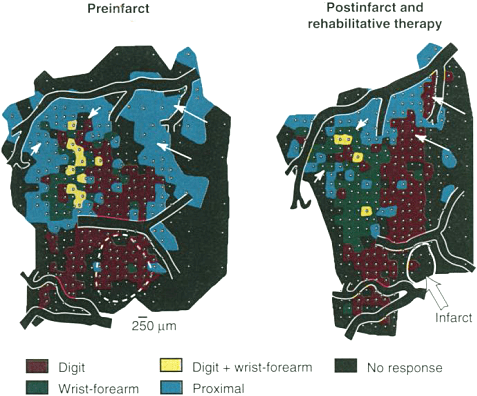
運動野(ブロードマン4野)に関しましては、Nudeら (文献9)はサルの一次運動野のdigit(濃い赤)の部位に脳梗塞infarctを作り(左の点線で囲まれた領域)、その後リハビリにて、青い領域(proximal)が狭くなり、その代わり濃い赤(digit)の領域が広がっていることを示した (文献8)。またリハビリ後梗塞巣infarct(左の点線で囲まれた部分)がリハビリで小さくなっている(右の大きな白い矢印で示された白線で囲まれた部分)ことを示した。長矢印は青(肘―肩)がリハビリで濃い赤(手指)に置き換わっていることを示している。短矢印は濃い赤(手指)や青(肘―肩)がリハビリ後、緑(手首―前腕)に置き換わっていることを示している。
Digit(手指)、Wrist-forearm(手首―前腕)、Proximal(肘―肩)
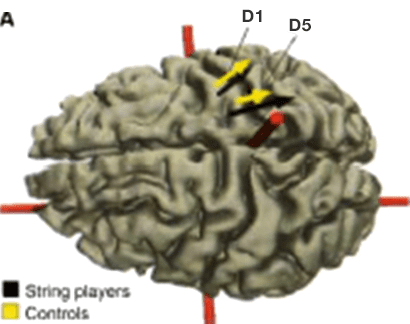
また、ヴァイオリンなどの弦楽器奏者を被検者とした実験で、興味深い知見が得られている。ヴァイオリンなどの楽器では、奏者は左手第1指で楽器のネックを押さえ、また左手第2~5指で弦を押さえて演奏する。その演奏には第1指と第5指の分離した巧緻な運動が求められる。これらの奏者を被検者として脳磁計を用い、左手の第1指から第5指にかけての体性局在が調べられた。その結果、弦楽奏者(string players)の第1指(D1)と第5指(D5)の体性局在は、対照群に比較して、皮質のより広い範囲にまたがることが示された( 文献10, p11-12、 文献11)。つまり、身体を使う頻度が高いほど、その体部位の再現領域が大きくなるような可塑的な変化を起こす。これは use-dependent plasticity(UDP:使用依存性可塑性)と呼ばれる。
「脳の可塑性」とは脳の神経細胞群が新たなネットワークを築き、生まれ変わることです(マクロ的可塑性)。繰り返し練習することで一過性ではなく持続的なネットワークが構築されることです。学習や記憶、麻痺の改善(運動学習)など。
また、個々の神経細胞の損傷あるいはシナプス結合が回復する機序は下記のように考えられております(ミクロ的可塑性、シナプスの可塑性))。
Types of recovery(回復のタイプ)( 文献12reviews)
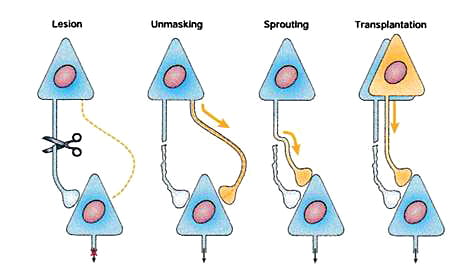
左端のように神経が損傷されると、①損傷前には機能していなかったシナプス結合が顕在化する(Unmasking;仮面をはがされること、顕在化)②新たな神経突起が発芽する(Sprouting)③神経幹細胞から新たな神経細胞が生まれて置き換わること(Transplantation)によって新たなシナプス結合ができる。
また、神経細胞(ニューロン)は様々な機能をもっております(神経伝達物質の種類による分類)(機能による分類)。アセチルコリン(ACh)を産生し放出するコリン作動性ニューロン(cholinergic neuron)。(-ergic; 作動性)。ノルアドレナリンを産生し放出するノルアドレナリン作動性ニューロン(noradrenergic neuron)、その他、ドーパミン作動性ニューロン(dopaminergic neuron)、γ-アミノ酪酸gamma-aminobutiric acid(GABA)作動性ニューロン(GABAergic・GABAregic neuron)、グルタミン酸作動性ニューロン(glutaminergic neuron)などがあります。GABAは抑制性に、グルタミン酸は興奮性に働きます。またそれぞれのニューロンはニコチン受容体、ムスカリン受容体;α受容体、β受容体;D1~5受容体など受容体サブタイプがあり、受容体によってそれぞれの機能が異なっております。
さらにXerrirらは以下のことを総説しました( 文献13reviews)。
マウスの脳卒中後のS1再マッピングの概略図( 文献13reviews)
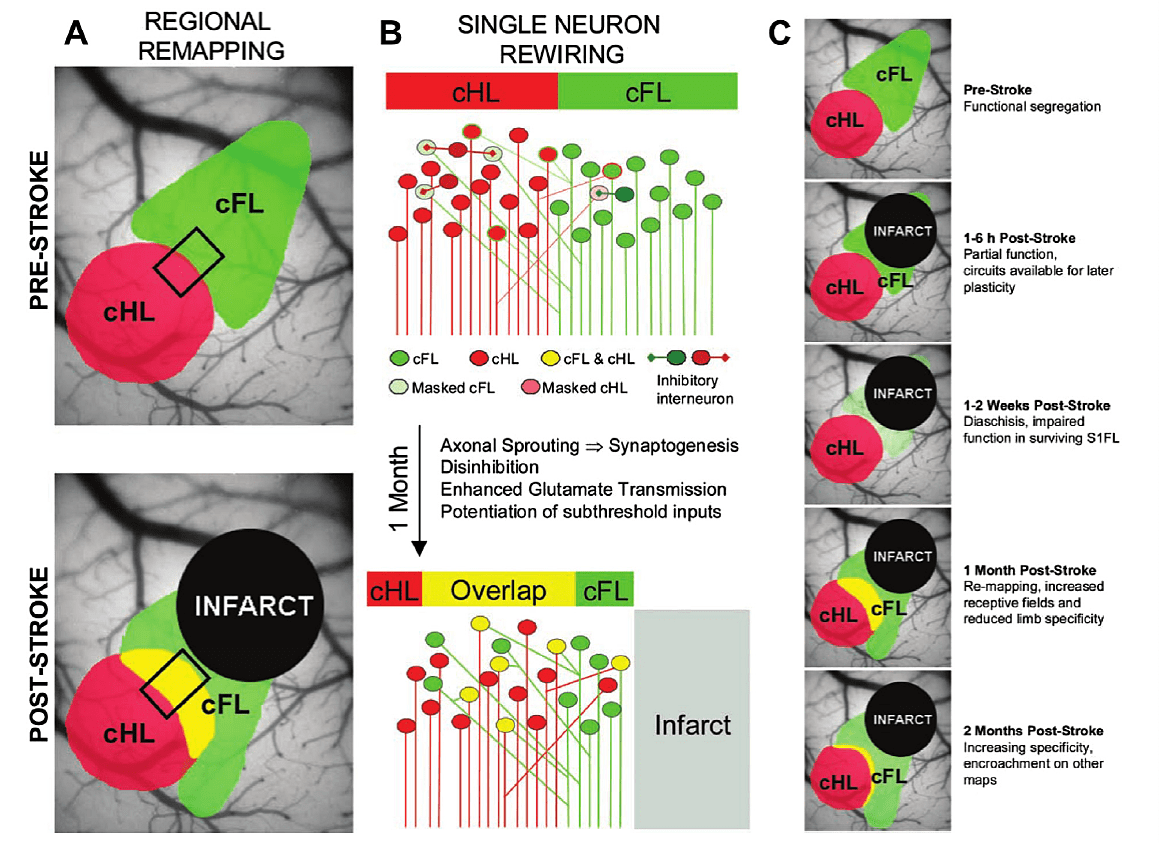
(A)上のパネル:正常な対側前肢(cFL)および後肢(cHL)の感覚マップ。下のパネル:前肢エリアをターゲットとしたミニストロークの1か月後の前肢と後肢のマップの再編成。黄色は、脳卒中回復中に発生する前肢マップと後肢マップの重複(overlap)を示している。
(B)梗塞前(上)と梗塞後(下)の単一ニューロンのイラスト;抑制性介在ニューロン(inhibitory interneurons)によって潜在的に前肢または後肢に反応するニューロンがマスク(抑制)されます。その結果、病変の前に、個々のニューロンは間の明確な分離を示します。脳卒中の1か月後、個々のニューロンのレベルでの前肢と後肢のマップの間はぼやけており、対側前肢(cFL)と後肢(cHL)の応答が重複している多くのニューロン(黄色)が観察される。これらのニューロンの活動性は、axonal sprouting(軸索発芽)/synaptogenesis(新規シナプス形成)、抑制性介在ニューロンの活動性の消失(脱抑制;Disinhibition)、(興奮性)グルタミン酸伝達の増強などによると推察されている。
(C)卒中後の対側感覚マップの領域再構築の時間経過のサマリー;1か月後overlapする領域(黄色)は広くなっているが、2か月後には縮小している。
S1と運動機能を障害する脳卒中の結果とconstraint-induced-movement therapy(CIMT)(CI療法)の神経科学的基盤( 文献13reviews)。
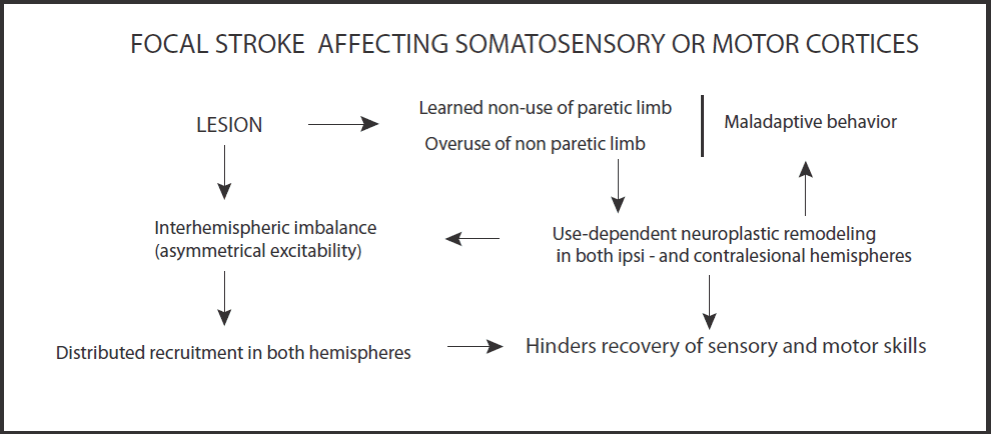
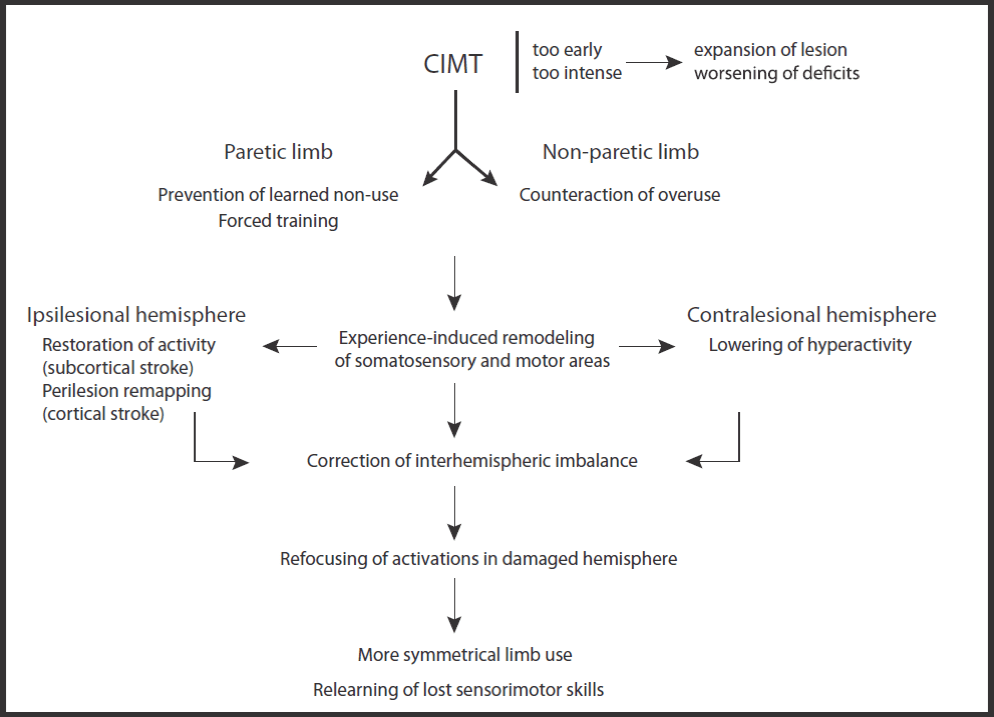
片側の皮質下あるいは皮質の卒中後、障害されたもの(主体)は、一般的に障害された上肢は使用せず(Learned non-use of paretic limb)、非障害側ばかり使用する(Overuse of non paretic limb)。この不使用は、主体が非麻痺上肢の過使用からなる戦略を開発する可能性があるという事実によって強化される。この学習された不使用は、病変によって誘発される半球間の興奮性の不均衡を悪化させる。CIMTは、健常な肢が制限されている間、障害された肢を数週間強制的に使用することによって、学習された不使用を克服することを目的とする。障害された肢の使用の増加は、徐々に 障害された肢のS1と運動機能の根底にある皮質ネットワークの経験に依存した再編成(Experience-induced remodeling )を導く。ある一定期間の後に、麻痺した肢の運動中に、同側および対側病変領域の両方における活動性、半球間の不均衡が減少する。機能の改善は、神経活動が同側半球に再び集中するにつれて発達し、より対称的な肢の使用を可能にする。CIMTによって誘発される感覚運動能力の回復は、使用に依存する神経可塑性(use-dependent neuroplasticity)に支えられた再学習プロセスとして考えることができる。
CI療法だけでなく、脳卒中の患者方々に対して、ロボット療法、hybrid assistive neuromuscular dynamic stimulation(HANDS)療法、促通反復療法など新たなリハビリテーションが生まれております。そしてそのリハビリテーションはニューロリハビリテーションあるいは神経リハビリテーションと呼ばれます。道免和久先生は「ニューロリハビリテーションとは、ニューロサイエンスとその関連の研究によって明らかになった脳の理論等の知見を、リハビリテーション医療に応用した概念、評方法、機械など」と定義し、言い換えれば「neuroscience based rehabilitation」と述べられております( 文献10)。
文献
- Brodmann K. Vergleichende Lokalisationslehre der Großhirnrinde : in ihren Prinzipien dargestellt auf Grund des Zellenbaues. J.A. Barth, 1909. p131.
- ベアー コノーズ パラディーソ. 神経科学-脳の探求-. 加藤宏司, 後藤薫, 藤井 聡, 山崎良彦(監訳). 東京. 西村書店;2007.
- Penfield W, Rasmussen T. The Cerebral Cortex of Man. MacMillan, New York, 1950.
- Gazzaniga MS, Ivry RB, Mangan GR. Cortical Topography. Cognitive Neuroscience: The biology of mind, 5th ed, New York 2019.
- 蔵田潔. ワイルダー・グレイヴス・ペンフィールド. 脳科学辞典. https://bsd.neuroinf.jp/wiki/ワイルダー・グレイヴス・ペンフィールド
- Kandel ER, Schwartz JH, Jessell TM, Siegelbaum SA, Hudspeth AH(編). 金澤一郎, 宮下保司(監修). カンデル神経科学. McGraw-Hill. メディカル・サイエンス・インターナショナル. 2013.
- Merzenich MM, Nelson RJ, Stryker MP, Cynader MS, Schoppmann A, Zook JM. Somatosensory cortical map changes following digit amputation in adult monkeys. J Comp Neurol.224:591-605,1984. Merzenich_Somatoensory_JCN_1984.pdf (ucsf.edu)
- Jenkins WM, Merzenich MM, Ochs MT, Allard T, Guis-Robles E. Functional reorganization of primary somatosensory cortex in adult owl monkeys after behaviorally controlled tactile stimulation. J Neurophysiol 63; 82-104, 1990. Functional reorganization of primary somatosensory cortex in adult owl monkeys after behaviorally controlled tactile stimulation (physiology.org)
- Nude RJ, Wise BM, SiFuentes F, et al. Neural Substrates for the E\effects of rehabilitative training on motor recovery after ischemic infarct. Science 272(5269);1791-1794, 1996.
- 道免和久(編). ニューロリハビリテーション. 東京:医学書院;2015.
- Elbert T, Pantev C, Wienbruch C, et al. Increased cortical representation of the fingers of the left hand in string players. Science 270;305-307, 1995.
- Taub E, Uswatte G, Elbert T. New treatments in neurorehabiliation founded on basic research. Nat Rev Neurosci 3;228-236, 2002.
- Xerri C, Zennou-azogui Y, Sadlaoud K, Sauvajon D. Interplay between intra- and interhemispheric remodeling of neural networks as a substrate of functional recovery after stroke: Adaptive versus maladaptive reorganization. Neuroscience 26(283); 178-201, 2014.

